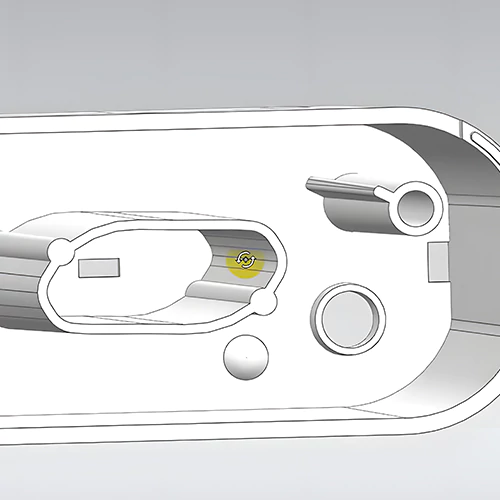
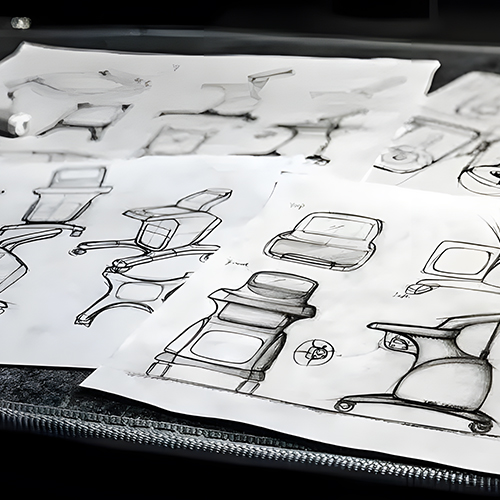
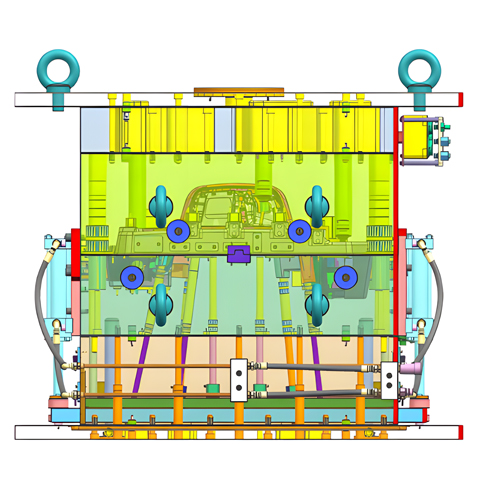
Una empresa profesional de diseño industrial especializada en dispositivos médicos cumplirá las estrictas normas de control de calidad en el diseño de dispositivos médicos y procesos de desarrollo de productos. Esto es crucial para garantizar la eficacia y la calidad del diseño y el desarrollo de productos médicos. Aquí compartimos los pasos comunes en el diseño y desarrollo de productos de dispositivos médicos.
1. Iniciación y aprobación del proyecto
Normalmente, cuando una empresa de diseño industrial recibe los requisitos de diseño de un producto médico de un cliente, emite un documento de tareas del proyecto en el que se anuncia que, a partir de ese momento, comienza el trabajo de diseño y desarrollo.

2. Planificación del diseño y desarrollo de productos sanitarios
Tras iniciar el proyecto, los diseñadores crean el correspondiente equipo de élite en función de los requisitos específicos de diseño, y cada miembro es responsable de su tarea respectiva. Una vez que el equipo ha terminado de diseñar y desarrollar un concepto, proponen diferentes conceptos como la función del dispositivo médico, es decir, lo que hace, el aspecto de la integridad estructural, los materiales utilizados en su proceso de fabricación, etc.
3. Elementos clave del diseño y el desarrollo
Las funciones, características, requisitos de seguridad y normas de gestión de riesgos del producto se definen a partir de los resultados de un estudio de mercado. Para ello, se tienen en cuenta varios aspectos: la aplicación principal del producto, sus características y ventajas, su potencial de servicio para satisfacer necesidades como la carga de trabajo del personal, la temperatura del aire, las precauciones de seguridad, la estabilidad de la posición, la duración del tiempo, las materias primas disponibles, etc. Estos aspectos se revisan críticamente, se confirman y se documentan con rigurosa precisión antes de difundir la documentación necesaria.
4. Resultados en diseño y desarrollo
El resultado del diseño debe cumplir en primer lugar los requisitos de entrada del diseño. Debe especificar detalladamente las materias primas necesarias, los componentes, las normas técnicas, las reglas de aceptación, las normas de ejecución del producto, los planos de ingeniería, los detalles de los componentes, el flujo del proceso de producción, el proceso de mecanizado, el equipo de la línea de producción, los prototipos, los procedimientos y métodos de ensayo, el envasado y las etiquetas de envasado. Además, hay que mantener meticulosamente los registros del proceso de diseño y desarrollo.

5. Revisión de los planes de diseño y desarrollo
Hay que revisar sistemáticamente los planes de diseño y desarrollo para garantizar su aplicabilidad y eficacia. Este proceso verifica que los resultados cumplen los objetivos generales. El propósito es evaluar si los resultados de las fases de diseño y desarrollo cumplen los requisitos especificados en el plan de diseño y se ajustan a las leyes y normativas pertinentes. En esta etapa se identifican las posibles deficiencias y se proponen soluciones para evitar la no conformidad del producto en una fase temprana.

6. Verificación del diseño y desarrollo
Para garantizar que los resultados del diseño y el desarrollo de productos sanitarios se ajustan a los insumos especificados, se debe llevar a cabo una verificación de acuerdo con la asignación prevista. Los métodos de verificación incluyen: el uso de diferentes enfoques para diseñar y verificar los datos de diseño o los requisitos; la comparación con diseños similares; la creación de prototipos para pruebas y demostraciones; la autocomprobación de prototipos; las pruebas de terceros; y la revisión de documentos.
7. Validación del diseño y el desarrollo
Para garantizar que el producto cumple las normas de usabilidad exigidas o el uso primario previsto conocido, la validación del diseño y desarrollo del producto sanitario debe llevarse a cabo de acuerdo con la asignación del plan de diseño. Esto incluye la evaluación clínica, las revisiones de simulación y comparación, y las evaluaciones de características.
Además, hay que realizar cambios de diseño y revisiones de cambios si es necesario. Es esencial exponer claramente los motivos, requisitos y normas de los cambios, que también deben someterse a revisión.