Ein professionelles Industriedesign-Unternehmen, das sich auf medizinische Geräte spezialisiert hat, hält sich an die strengen Qualitätskontrollvorschriften für das Design medizinischer Geräte und Produktentwicklungsprozesse. Dies ist von entscheidender Bedeutung für die Gewährleistung der Effizienz und Qualität des Designs und der Entwicklung von Medizinprodukten. Im Folgenden werden die gemeinsamen Schritte bei der Konzeption und Entwicklung von Medizinprodukten erläutert.
1. Projektinitiierung und -genehmigung
Wenn ein Industriedesignunternehmen die Designanforderungen eines Kunden für ein medizinisches Produkt erhält, stellt es in der Regel ein Projektauftragsdokument aus, das ankündigt, dass von nun an die Arbeit am Design und an der Entwicklung beginnt.

2. Planung für Design und Entwicklung von Medizinprodukten
Nach der Initiierung des Projekts stellen die Designer auf der Grundlage der spezifischen Designanforderungen ein entsprechendes Eliteteam zusammen, wobei jedes Mitglied für seine jeweilige Aufgabe verantwortlich ist. Sobald das Team den Entwurf und die Entwicklung eines Konzepts abgeschlossen hat, schlagen sie verschiedene Konzepte vor, z. B. die Funktion des Medizinprodukts, d. h. was es tut, das Aussehen der strukturellen Integrität, die im Herstellungsprozess verwendeten Materialien
3. Wichtige Inputs für Design und Entwicklung
Die Funktionen, Merkmale, Sicherheitsanforderungen und Risikomanagementvorschriften des Produkts werden auf der Grundlage von Marktforschungsergebnissen festgelegt. Dabei werden verschiedene Aspekte berücksichtigt: die Hauptanwendung, die Eigenschaften und der Nutzen des Produkts, seine Fähigkeit, im Betrieb Anforderungen wie die Arbeitsbelastung des Personals, die Lufttemperatur, die Sicherheitsvorkehrungen, die Stabilität der Position, die Zeitspanne, die verfügbaren Rohstoffe usw. zu erfüllen. Diese Aspekte werden kritisch geprüft, bestätigt und mit strenger Präzision dokumentiert, bevor die erforderlichen Unterlagen in Umlauf gebracht werden.
4. Outputs in Design und Entwicklung
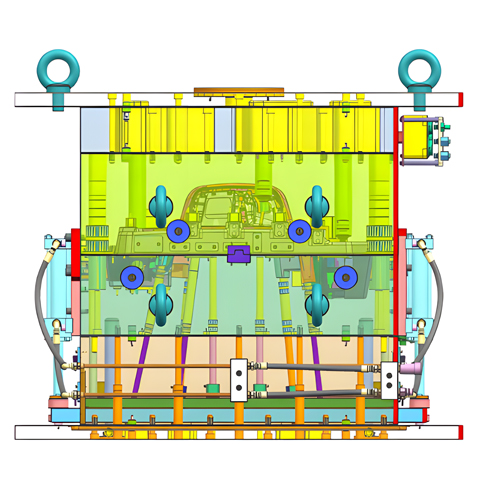
Die Entwurfsergebnisse sollten zunächst die Anforderungen an den Entwurf erfüllen. Es muss die erforderlichen Rohstoffe, Bauteile, technischen Normen, Abnahmeregeln, Produktausführungsnormen, technischen Zeichnungen, Bauteildetails, den Produktionsablauf, den Bearbeitungsprozess, die Ausrüstung der Produktionslinie, Prototypen, Prüfverfahren und -methoden, Verpackungen und Verpackungsetiketten detailliert angeben. Darüber hinaus sollten Aufzeichnungen über den Entwurfs- und Entwicklungsprozess akribisch geführt werden.

5. Überprüfung von Entwurfs- und Entwicklungsplänen
Die Entwurfs- und Entwicklungspläne sollten systematisch überprüft werden, um ihre Anwendbarkeit und Wirksamkeit sicherzustellen. Bei diesem Prozess wird überprüft, ob die Ergebnisse den Gesamtzielen entsprechen. Es soll bewertet werden, ob die Ergebnisse der Entwurfs- und Entwicklungsphasen die im Entwurfsplan festgelegten Anforderungen erfüllen und den einschlägigen Gesetzen und Vorschriften entsprechen. In diesem Schritt werden etwaige Unzulänglichkeiten ermittelt und Lösungen vorgeschlagen, um die Nichtkonformität des Produkts in einem frühen Stadium zu verhindern.

6. Verifizierung von Design und Entwicklung
Um sicherzustellen, dass die Ergebnisse des Designs und der Entwicklung von Medizinprodukten mit den spezifizierten Eingaben übereinstimmen, sollte man die Verifizierung entsprechend der geplanten Zuordnung durchführen. Zu den Verifizierungsmethoden gehören: die Verwendung verschiedener Ansätze für den Entwurf und die Überprüfung anhand der Entwurfsdaten oder -anforderungen, der Vergleich mit ähnlichen Entwürfen, die Erstellung von Prototypen zur Prüfung und Demonstration, die Selbstprüfung von Prototypen, die Prüfung durch Dritte und die Überprüfung von Dokumenten.
7. Validierung von Design und Entwicklung
Um sicherzustellen, dass das Produkt die geforderten Normen für die Gebrauchstauglichkeit oder die bekannte erwartete Hauptanwendung erfüllt, sollte die Validierung des Designs und der Entwicklung des Medizinprodukts entsprechend der Zuordnung im Designplan durchgeführt werden. Dies umfasst klinische Bewertungen, Simulations- und Vergleichsprüfungen sowie Funktionsbewertungen.
Darüber hinaus sollte man bei Bedarf Entwurfsänderungen und Änderungsprüfungen durchführen. Es ist wichtig, die Gründe, Anforderungen und Standards für Änderungen klar zu benennen, und diese Änderungen müssen ebenfalls überprüft werden.