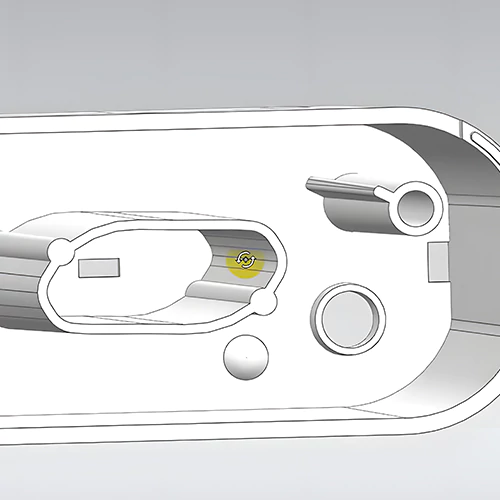
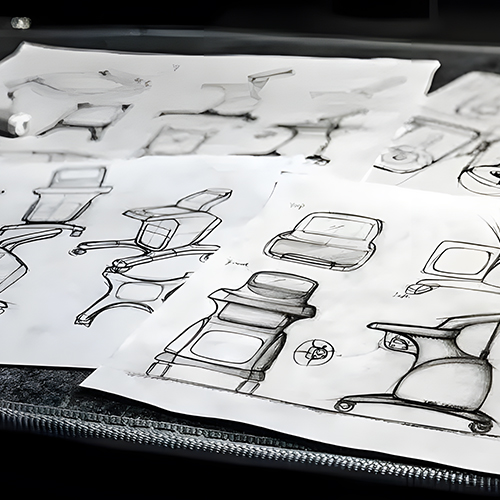
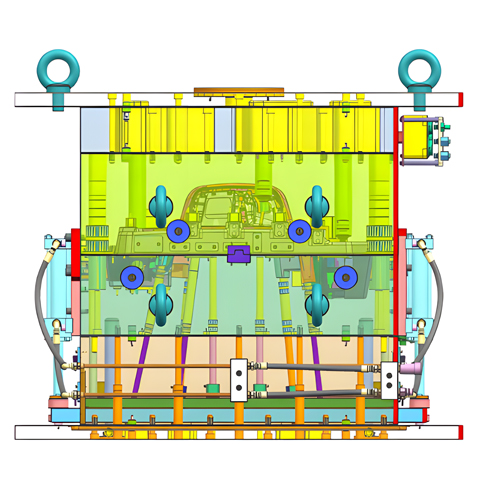
Une société de conception industrielle professionnelle spécialisée dans les dispositifs médicaux se conformera à des règles strictes de contrôle de la qualité en matière de conception et de fabrication de dispositifs médicaux. les processus de développement de produits. Cette étape est cruciale pour garantir l'efficacité et la qualité de la conception et du développement des produits médicaux. Nous vous présentons ici les étapes communes de la conception et du développement d'un produit médical.
1. Lancement et approbation du projet
Normalement, lorsqu'une société de design industriel reçoit les exigences d'un client en matière de conception de produits médicaux, elle émet un document de projet annonçant que le début de ce projet signifie que le travail de conception et de développement a commencé.

2. Planification de la conception et du développement des dispositifs médicaux
Après avoir lancé le projet, les concepteurs créent une équipe d'élite correspondante sur la base d'exigences de conception spécifiques, chaque membre étant responsable de sa tâche respective. Une fois que l'équipe a terminé la conception et le développement d'un concept, elle propose différents concepts tels que la fonction du dispositif médical, c'est-à-dire ce qu'il fait, l'apparence de l'intégrité structurelle, les matériaux utilisés dans son processus de fabrication, etc.
3. Principaux intrants de la conception et du développement
Les fonctions, les caractéristiques, les exigences de sécurité et les règles de gestion des risques du produit sont définies sur la base des résultats de l'étude de marché. Cela implique de prendre en compte différents aspects : ceux de l'application principale du produit, ses caractéristiques et ses avantages, son potentiel en service pour satisfaire des besoins tels que la charge de travail du personnel, la température de l'air, les précautions de sécurité, la stabilité de la position, la durée de vie des matières premières disponibles, etc. Ces aspects sont examinés de manière critique, confirmés et documentés avec une précision rigoureuse avant que la documentation nécessaire ne soit diffusée.
4. Résultats en matière de conception et de développement
Le résultat de la conception doit d'abord répondre aux exigences de l'entrée de la conception. Il doit spécifier en détail les matières premières, les composants, les normes techniques, les règles d'acceptation, les normes d'exécution du produit, les dessins techniques, les détails des composants, le déroulement du processus de production, le processus d'usinage, l'équipement de la chaîne de production, les prototypes, les procédures et méthodes d'essai, l'emballage et les étiquettes d'emballage. En outre, il convient de conserver méticuleusement les documents relatifs au processus de conception et de développement.

5. Examen des plans de conception et de développement
Il convient d'examiner systématiquement les plans de conception et de développement pour s'assurer de leur applicabilité et de leur efficacité. Ce processus permet de vérifier que les résultats répondent aux objectifs généraux. Il s'agit d'évaluer si les résultats des phases de conception et de développement répondent aux exigences spécifiées dans le plan de conception et s'ils sont conformes aux lois et règlements en vigueur. Cette étape permet d'identifier les éventuelles lacunes et de proposer des solutions pour éviter la non-conformité du produit à un stade précoce.

6. Vérification de la conception et du développement
Pour s'assurer que les résultats de la conception et du développement d'un dispositif médical correspondent aux données d'entrée spécifiées, il convient de procéder à une vérification conformément à l'affectation prévue. Les méthodes de vérification comprennent : l'utilisation de différentes approches pour la conception et la vérification par rapport aux données de conception ou aux exigences ; la comparaison avec des conceptions similaires ; le prototypage pour les essais et la démonstration ; l'auto-test des prototypes ; les essais par des tiers ; et l'examen des documents.
7. Validation de la conception et du développement
Pour s'assurer que le produit répond aux normes d'utilisabilité requises ou à l'utilisation principale prévue, la validation de la conception et du développement du dispositif médical doit être effectuée conformément à l'affectation du plan de conception. Cela comprend l'évaluation clinique, la simulation et les examens comparatifs, ainsi que l'évaluation des caractéristiques.
En outre, il convient de procéder à des modifications de la conception et à des examens des modifications si nécessaire. Il est essentiel d'énoncer clairement les raisons, les exigences et les normes des changements, et ces changements doivent également faire l'objet d'un examen.